Accueil > SPIP > Plugin Jeux > Jeu du pendu avec SPIP, Thème : Séries chimiques et Groupes du tableau (...)
 Jeu du pendu avec SPIP, Thème : Séries chimiques et Groupes du tableau périodique
Jeu du pendu avec SPIP, Thème : Séries chimiques et Groupes du tableau périodique
mardi 26 juillet 2011, par
Notez cet articlePréambule
Ces jeux sont présentés ici à titre d ’exemples d’utilisation du plugin « Des jeux dans vos articles ! » pour illustrer leur simplicité et leur facilité de création. Ils sont ici appliqués à un thème de la chimie en vue de faciliter son utilisation à des fins pédagogiques diverses et variées par les enseignants pour toutes disciplines.
Séries chimiques
Remarque : dans ce jeu les mots ont systématiquement séparés par un trait d’union en lieu et place de l’espace.
Documentation Wikipedia :
Une série chimique est un groupe d’éléments chimiques dont les propriétés chimiques et physiques varient progressivement d’un bout de la série à l’autre.
Les séries chimiques furent découvertes avant la création du tableau périodique des éléments, qui fut justement inventé pour essayer d’organiser les éléments en fonction de leurs propriétés chimiques.
De nombreuses séries chimiques correspondent exactement à un groupe de la table périodique. Ceci n’est pas une coïncidence, mais comme les propriétés qui groupent les éléments entre eux proviennent d’une même configuration des orbitales électroniques, ceci les place logiquement dans le même groupe du tableau périodique.
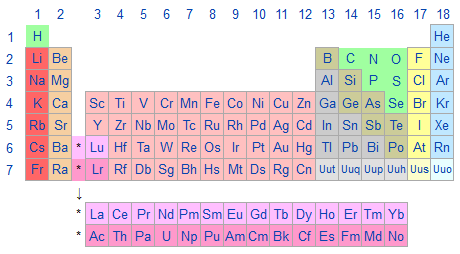
Un groupe du tableau périodique est une colonne verticale du tableau périodique des éléments. Il y a 18 groupes dans la table standard.
Plusieurs de ces groupes correspondent directement à une série chimique, car le tableau a été conçu pour organiser les séries chimiques connues dans un schéma cohérent.
L’explication moderne des motifs dans le tableau périodique provient du fait que les éléments d’un même groupe possèdent la même configuration électronique de leur couche la plus extérieure. Comme le comportement chimique est principalement dicté par les interactions de ces électrons, cela tend à donner aux éléments d’un même groupe les mêmes propriétés chimiques et physiques.
Information (Wikipedia)
- Tableau périodique des éléments détaillé
- Tableau périodique des éléments
- Groupe du tableau périodique
- Série chimique
Halogènes
Information (Wikipedia) :
Le terme halogène désigne les éléments chimiques de la 17e colonne du tableau périodique, anciennement appelé groupe VII ou VIIA. Ces éléments chimiques sont : F, Cl, Br, I et At.
le fluor 9F, le chlore 17Cl, le brome 35Br, l’iode 53I et l’astate 85At.Le mot « halogène » vient du grec « hals » qui veut dire sel, et « gennán » qui porte l’idée d’engendrer. Le nom « halogène » a été introduit en 1811 pour désigner le dichlore qui était connu pour attaquer les métaux et donner des sels. Le nom a depuis été étendu à toute la famille ou série chimique.
Gaz nobles ( gaz rares)
Information (Wikipedia) :
On appelle gaz nobles, ou plus couramment gaz rares, les éléments chimiques du groupe 18 (anciennement « groupe VIIIA » voire « groupe 0 ») du tableau périodique des éléments. L’appellation gaz rares vient de leur faible prévalence historique comme substance chimique, bien que cela soit plutôt impropre car l’hélium constitue 24 % de la matière baryonique de l’univers, et l’argon 0,94 % de l’atmosphère terrestre au niveau de la mer. Autrefois également appelés gaz inertes, cette appellation est tombée en désuétude depuis qu’on a synthétisé des centaines de composés du xénon. Préconisée par l’IUPAC et le Bulletin officiel du ministère français de l’Éducation nationale1, l’appellation gaz nobles, issue de l’allemand Edelgas par analogie avec les métaux nobles (tels que l’or, également peu réactif), apparaît donc de plus en plus comme devant légitimement remplacer à terme celle de gaz rares ; c’est celle retenue dans cet article.
Les gaz nobles forment une série chimique ayant des propriétés assez homogènes : aux conditions normales de température et de pression, ce sont des gaz monoatomiques incolores et inodores quasiment dépourvus de réactivité chimique, dont les points de fusion et d’ébullition sont séparés de moins de 10 °C à pression atmosphérique.
Les six gaz nobles naturels sont He, Ne, Ar, Kr, Xe et Rn
Métaux alcalins
Information (Wikipedia) :
Un métal alcalin est un élément chimique de la première colonne (groupe 1, excepté l’H) du tableau périodique des éléments : Li, Na, K, Rb, Cs et Fr.
Très réactifs, ils ne se trouvent jamais à l’état élémentaire dans le milieu naturel, et réagissent immédiatement en présence d’humidité ; on les conserve par conséquent immergés dans de l’huile minérale, par exemple de l’huile de vaseline.
Le mot alcalin provient, via le mot d’emprunt alcali, de l’arabe al-qily signifiant la soude.
Métaux alcalino-terreux
Information (Wikipedia) :
Un métal alcalino-terreux ou alcalinoterreux est un élément chimique de la deuxième colonne du tableau périodique des éléments. Ce nom vient du terme « métaux de terre » utilisé en alchimie et décrivant les métaux qui résistent au feu, les oxydes de métaux alcalino-terreux demeurant solides à des températures très élevées.
La série des métaux alcalino-terreux se confond avec les éléments du groupe 2 (anciennement IIA) : Be, Mg, Ca, Sr, Ba et Ra.
Lanthanides
Information (Wikipedia) :
L’UICPA définit comme lanthanide tout élément chimique parmi les quinze de numéros atomiques compris entre 57 La) et 71 (Lu) : La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb et Lu. Ce terme est plus ou moins synonyme de l’ancienne appellation de terre rare pour ces éléments.
L’étymologie de leur nom dérive du grec ancien qui signifie « rester caché », appliqué au lanthane en raison de la difficulté à l’isoler de l’oxyde de cérium.
Actinides
Information (Wikipedia) :
La série chimique des actinides comprend les éléments chimiques du tableau périodique se situant entre l’actinium et le lawrencium, possédant donc un numéro atomique entre 89 et 103 inclus : Ac, Am, Bk, Cf, Cm, Es, Fm, Lw, Md, Np, No, Pu, Pa, Th et U.
Les actinides sont tous des éléments radioactifs et tirent leur nom de l’actinium (Z=89), un métal lourd, car ils possèdent des propriétés chimiques voisines. L’uranium et le thorium, qui sont relativement abondants à l’état naturel du fait de la très longue demi-vie de leurs isotopes les plus stables, sont des actinides. Les actinides comprennent des éléments artificiels, les transuraniens, plus lourds que l’uranium : ils sont générés par des captures de neutrons qui n’ont pas été suivies de fissions.
Métaux pauvres
Information (Wikipedia) :
On appelle métal pauvre un élément métallique du bloc p dans le tableau périodique. Il s’agit des éléments suivants : Al, Ga, In, Sn, Tl, Pb et Bi.
Hormis l’aluminium, ils sont plutôt mous, avec une température de fusion et d’ébullition inférieures à celles des métaux de transition ainsi qu’une électronégativité plus élevée. Par rapport aux métalloïdes de même période, ils se caractérisent par une température d’ébullition sensiblement plus élevée.
Métaux de transition
Information (Wikipedia) :
On appelle métal de transition un élément chimique du bloc d du tableau périodique qui n’est ni un lanthanide ni un actinide. Il s’agit des 38 éléments des périodes 4 à 7 et des groupes 3 à 12 hormis le lutécium 71Lu (un lanthanide) et le lawrencium 103Lr (un actinide) : Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg, Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg et Cn.
Il existe en fait plusieurs définitions possibles des métaux de transition qui conduisent à délimiter de façon différente l’ensemble des éléments concernés :
- On confond parfois les métaux de transition avec les éléments du bloc d, ce qui conduit à inclure le lutécium et le lawrencium ; cette définition est assez logique mais l’UICPA définit expressément ces éléments respectivement comme un lanthanide et un actinide, ce qui les exclut du champ des métaux de transition.
- L’UICPA définit les métaux de transition comme les éléments qui ont une sous-couche d incomplète ou qui peuvent donner un cation ayant une sous-couche d incomplète. Cette définition revient à exclure les éléments du groupe 12 (zinc, cadmium, mercure et copernicium), qui ont une sous-couche d compl
ète1, et pose un problème pour le lutécium et le lawrencium, qui se retrouvent ainsi affectés à deux séries chacun.
Métalloïdes
Information (Wikipedia) :
Le terme métalloïde n’est plus en usage. Il n’est pas mentionné dans le Gold Book de l’IUPAC1 qui reconnaît en revanche les termes métal et non-métal. Par ailleurs, aucun livre de chimie inorganique actuel2, voire un peu ancien3, de niveau académique, n’y fait référence.
Auparavant, un métalloïde était un élément chimique qui ne pouvait être classé ni dans les métaux ni parmi les non-métaux4, c’est-à-dire dont les propriétés physiques et chimiques sont intermédiaires entre celles d’un métal et d’un non-métal. Les métalloïdes étaient caractérisés par les propriétés suivantes :
leurs oxydes sont généralement amphotères (ceux des métaux sont plutôt basiques et ceux des non-métaux plutôt acides) ;
ils se comportent comme des semiconducteurs (notamment le bore, le silicium et le germanium).Les métalloïdes forment donc une bande oblique dans le tableau périodique entre les métaux et les non-métaux : B, Si, Ge, As, Sb, Te et Po.
Non-métaux
Information (Wikipedia) :
Les non-métaux forment une série chimique du tableau périodique qui regroupe les éléments qui ne sont ni des métaux, ni des métalloïdes, ni des halogènes, ni des gaz rares1. Cette série comprend : H, C, N, O, P, S et Se.
Les propriétés physiques des non-métaux les différencient nettement des métaux : une densité, des températures de changement d’état, des conductivités électrique et thermique plus faibles que celles des métaux. Ils se caractérisent aussi par une forte électronégativité, des oxydes acides et une absence de malléabilité et de ductilité à l’état solide. Certains allotropes du carbone (notamment le graphite) et du phosphore ont toutefois des propriétés qui les rapprochent des métalloïdes ; l’hydrogène se comporte comme un métal à haute pression (hydrogène métallique2). Les non-métaux forment généralement des liaisons ioniques avec les métaux.
Mis à part le sélénium qui est un oligo-élément, les non-métaux sont des macro-éléments qui entrent dans la structure des principales molécules du vivant.